Wie funktioniert eine Wanduhr, eine TV-Fernbedienung oder ein funkgesteuertes Kinderspielzeug? Die meisten Leute werden ohne zu zögern antworten - "aus Batterien" und werden im Prinzip Recht haben. Aber kaum einer von ihnen wird sagen können, wie genau ein tragbarer Akku verdreifacht wird, wie er Funktionen und ohne die der gesamte Prozess der Übertragung des elektrischen Stroms von der Batterie zum Endverbraucher wäre unmöglich. Lassen Sie uns diese nervige Wissenslücke schließen.
So funktioniert der Akku
Der Inhalt des Artikels
- So funktioniert der Akku
- Wie funktioniert ein Akku, der Unterschied zu einem herkömmlichen?
Um das Funktionsprinzip einer herkömmlichen "Finger" -Batterie zu verstehen, ist eine allgemeine Vorstellung von ihrem Aufbau erforderlich. Jede Batterie besteht also aus drei Hauptelementen - Anode, Kathode und Elektrolyt. Letztere können zudem praktisch jeden Aggregatzustand haben: in eine Kochsalzlösung gegeben Kathode und Anode sind im Prinzip auch eine "Batterie", nur in ungewöhnlicher Weise für den Durchschnittsmenschen Form.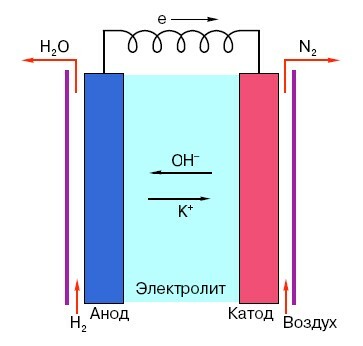
Interessant! Auch die von Alessandro Volta erfundene sogenannte "Voltaische Säule" verfügte über alle notwendigen Elemente zur Stromerzeugung. Es bestand aus übereinander gestapelten Zink- und Kupferplatten, zwischen denen ein säuregetränktes Tuch als „Schicht“ gelegt wurde.
Die Anode in solchen Systemen ist die Hauptquelle für Elektronen, die, wie wir aus dem Schulphysikunterricht wissen, negativ geladen sind. Negativ geladene Teilchen werden von positiven angezogen, und in diesem Fall wirkt die Kathodenoberfläche als "Plus".
Doch für die Entstehung eines elektrischen Stroms reicht dies nicht aus, denn auch Elektronen brauchen eine Art „Autobahn“ – ein Medium, das die Wechselwirkung von Kathode und Anode unterstützen würde. Hier erscheint der Elektrolyt "vor Ort" - Salz, Lauge oder Säure, die Strom leiten kann.
Analysieren wir das Funktionsprinzip an einem konkreten Beispiel: Es gibt eine Batterie, die für 18 Volt ausgelegt ist. Die Spannung zwischen den Elektroden darin ist stabil, bis es an das Netzwerk angeschlossen wird. Sobald ein Verbraucher erscheint (zum Beispiel eine gewöhnliche Glühbirne), beginnt die Spannung allmählich abzunehmen, von der "negativen" Elektrode zu Es beginnt ein "positiver" Strom zu fließen, und im Elektrolyten findet eine chemische Reaktion statt, die darauf abzielt, die Potenzialdifferenz zwischen. aufrechtzuerhalten Elektroden.
Bezug. Je mehr Energie der Verbraucher benötigt, desto intensiver verläuft die Reaktion im Inneren der Batterie und desto schneller fällt sie aus.
Wie funktioniert ein Akku, der Unterschied zu einem herkömmlichen?
Wir haben also die klassischen "Finger"- und "Little-Finger"-Akkus untersucht und wissen, dass die Lebensdauer der meisten von ihnen streng begrenzt ist (was auch immer die namhaften Hersteller sagen mögen). Aber was ist mit den sogenannten Akkumulatoren – Akkus, die während der Reaktion Energie nicht nur verbrauchen, sondern auch akkumulieren und lange speichern können?
Um das Prinzip der Batterie zu verstehen, muss man sich der Chemie zuwenden. Nehmen wir als Beispiel... Ein gewöhnliches Holzkohlefeuer. So schön und bezaubernd die Flamme auch aussehen mag, jeder Chemiker, der sie beobachtet, weiß, dass dieser Prozess nur eine langfristige Oxidationsreaktion des Brennstoffs ist. Verbrennende Kohle interagiert mit Sauerstoff und als Ergebnis dieser Reaktion erhalten wir:
- Kohlendioxid;
- Licht;
- herzlich.
Und wenn die letzten beiden Punkte die Seele und den Körper erwärmen können, dann können wir Kohlendioxid in keiner Weise verwenden, denn es ist ein Nebenprodukt der Reaktion, das eigentlich sein Abfall ist. Die Oxidationsreaktion stoppt, wenn die Ausgangselemente aufgebraucht sind: Sauerstoff und Kohle. Das Stoppen der Reaktion in der Batterie erfolgt in gleicher Weise, wenn sich die Ausgangsstoffe vollständig erschöpfen und nur noch „Müll“ übrig bleibt.
Bei der Batterie läuft alles etwas anders ab. Tatsache ist, dass die darin ablaufende Reaktion zur Kategorie der reversiblen gehört, dh unter bestimmten Bedingungen kann sie "umgekehrt" werden, indem alle Substanzen in ihren ursprünglichen Zustand zurückversetzt werden. Es ist die Möglichkeit einer reversiblen Reaktion in der Batterie, die das Laden ermöglicht.
Bei einer an das Netz angeschlossenen Batterie verläuft die Reaktion in die entgegengesetzte Richtung und der Strom fließt von "Plus" nach "Minus" und nicht umgekehrt. Als Ergebnis bildet das Reaktionsprodukt die Ausgangsstoffe und der Besitzer der Batterie erhält verfügbare „zurückgewonnene“ Energie in tragbarer Form. Das ist alles!
Abonnieren Sie unsere sozialen Netzwerke


