¿Cómo funciona un reloj de pared, un control remoto de televisión o un juguete infantil controlado por radio? La mayoría de la gente, sin dudarlo, responderá "con pilas" y, en principio, tendrá razón. Pero casi ninguno de ellos podrá decir cómo se triplica exactamente una batería portátil, cómo funciones y sin las cuales todo el proceso de transferencia de corriente eléctrica desde la batería al consumidor final sería imposible. Llenemos este molesto vacío de conocimiento.
Como funciona la bateria
El contenido del artículo
- Como funciona la bateria
- ¿Cómo funciona una batería recargable, a diferencia de una convencional?
Para comprender el principio de funcionamiento de una batería de "dedo" convencional, debe tener una idea general de su estructura. Entonces, cualquier batería consta de tres elementos principales: ánodo, cátodo y electrolito. Además, este último puede tener prácticamente cualquier estado de agregación: colocado en una solución salina el cátodo y el ánodo, en principio, también son una "batería", solo de una manera inusual para el hombre promedio en la calle formulario.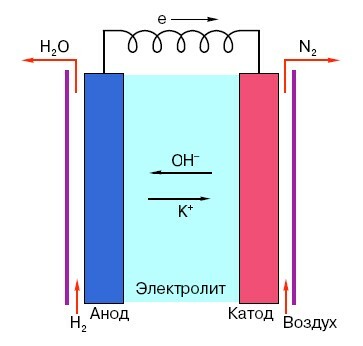
¡Interesante! El llamado "pilar voltaico", inventado por Alessandro Volta, también tenía todos los elementos necesarios para la producción de corriente eléctrica. Consistía en placas de zinc y cobre apiladas una encima de la otra, entre las cuales se colocaba una tela empapada en ácido a modo de "capa".
El ánodo en tales sistemas es la principal fuente de electrones que, como sabemos por el curso de física de la escuela, tienen una carga negativa. Las partículas cargadas negativamente son atraídas por las positivas y, en este caso, la superficie del cátodo actúa como un "plus".
Pero para la aparición de una corriente eléctrica, esto no es suficiente, porque los electrones también necesitan una especie de "autopista", un medio que sustente la interacción del cátodo y el ánodo. Es aquí donde el electrolito aparece "en escena": sal, álcali o ácido capaz de conducir la corriente.
Analicemos el principio de funcionamiento con un ejemplo específico: hay una batería diseñada para 18 voltios. El voltaje entre los electrodos es estable hasta que se conecta a la red. Tan pronto como aparece un consumidor (por ejemplo, una bombilla normal), el voltaje comienza a disminuir gradualmente, desde el electrodo "negativo" a La corriente "positiva" comenzará a fluir y se producirá una reacción química en el electrolito, dirigida a mantener la diferencia de potencial entre electrodos.
Referencia. Cuanta más energía necesite el consumidor, más intensa será la reacción dentro de la batería y más rápido fallará.
¿Cómo funciona una batería recargable, a diferencia de una convencional?
Por lo tanto, hemos examinado las baterías clásicas de "dedo" y "dedo meñique" y sabemos que la vida útil de la mayoría de ellas es estrictamente limitada (digan lo que digan los fabricantes eminentes). Pero, ¿qué pasa con las llamadas baterías acumuladoras, baterías recargables que no solo pueden consumir energía durante la reacción, sino que también la acumulan y almacenan durante mucho tiempo?
Para comprender el principio de la batería, es necesario recurrir a la química. Tomemos como ejemplo... Un fuego de carbón ordinario. No importa cuán hermosa y hechizante pueda parecer la llama, cualquier químico que la observe sabe que este proceso es solo una reacción de oxidación a largo plazo del combustible. El carbón en llamas interactúa con el oxígeno y como resultado de esta reacción obtenemos:
- dióxido de carbono;
- luz;
- calurosamente.
Y si los dos últimos puntos pueden calentar el alma y el cuerpo, entonces no podemos usar dióxido de carbono de ninguna manera, porque es un subproducto de la reacción, que es, de hecho, su desperdicio. La reacción de oxidación se detiene cuando se agotan los elementos iniciales: oxígeno y carbón. La parada de la reacción en la batería se produce de la misma forma cuando las sustancias de partida se agotan por completo y sólo quedan "residuos".
En la batería, todo sucede de forma un poco diferente. El caso es que la reacción que tiene lugar en él pertenece a la categoría de reversible, es decir, en determinadas condiciones, se puede "revertir" devolviendo todas las sustancias a su estado original. Es la posibilidad de una reacción reversible en la batería lo que permite cargarla.
En una batería conectada a la red, la reacción procede en sentido contrario y la corriente fluye de "más" a "menos", y no al revés. Como resultado, el producto de reacción forma las sustancias iniciales y el propietario de la batería recibe la energía "recuperada" disponible en un formato portátil. ¡Eso es todo!
Suscríbete a nuestras redes sociales


