Ako fungujú nástenné hodiny, televízny diaľkový ovládač alebo rádiom ovládaná detská hračka? Väčšina ľudí bez váhania odpovie - „z batérií“ a v zásade bude mať pravdu. Len málokto z nich však bude schopný povedať, ako presne sa prenosná batéria strojnásobí a ako funkcie a bez ktorých by bol celý proces prenosu elektrického prúdu z batérie na konečného spotrebiteľa nemožné. Vyplnime túto nepríjemnú medzeru vo vedomostiach.
Ako funguje batéria
Obsah článku
- Ako funguje batéria
- Ako funguje nabíjateľná batéria a v čom sa líši od konvenčnej
Aby sme pochopili princíp fungovania konvenčnej „prstovej“ batérie, je potrebné mať všeobecnú predstavu o jej štruktúre. Každá batéria sa teda skladá z troch hlavných prvkov - anódy, katódy a elektrolytu. Navyše, tento môže mať prakticky akýkoľvek stav agregácie: umiestnený do fyziologického roztoku katóda a anóda sú v zásade tiež „batériou“, pre bežného muža na ulici len neobvyklým spôsobom forma.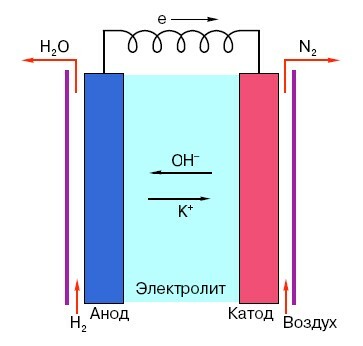
Zaujímavé! Takzvaný „voltaický stĺp“, ktorý vynašiel Alessandro Volta, mal tiež všetky prvky potrebné na výrobu elektrického prúdu. Pozostával zo zinkových a medených plátov poukladaných na seba, medzi ktoré sa ako „vrstva“ položila tkanina namočená v kyseline.
Anóda v takýchto systémoch je hlavným zdrojom elektrónov, ktoré, ako poznáme zo školského kurzu fyziky, majú negatívny náboj. Negatívne nabité častice sú priťahované k pozitívnym a v tomto prípade povrch katódy pôsobí ako „plus“.
Ale na vznik elektrického prúdu to nestačí, pretože elektróny potrebujú aj akúsi „diaľnicu“ - médium, ktoré by podporovalo interakciu katódy a anódy. Práve tu sa „na scéne“ objavuje elektrolyt - soľ, zásada alebo kyselina schopná viesť prúd.
Analyzujme princíp činnosti na konkrétnom príklade: existuje batéria navrhnutá pre 18 voltov. Napätie medzi elektródami v ňom je stabilné, kým nie je pripojené k sieti. Akonáhle sa objaví spotrebiteľ (napríklad obyčajná žiarovka), napätie začne postupne klesať, od „zápornej“ elektródy po Začne prúdiť „pozitívny“ prúd a v elektrolyte bude prebiehať chemická reakcia zameraná na udržanie potenciálneho rozdielu medzi elektródy.
Referencia. Čím viac energie spotrebiteľ potrebuje, tým intenzívnejšia reakcia prúdi do batérie a tým rýchlejšie zlyhá.
Ako funguje nabíjateľná batéria a v čom sa líši od konvenčnej
Preskúmali sme teda klasické „prstové“ a „malíčkové“ batérie a vieme, že životnosť väčšiny z nich je prísne obmedzená (bez ohľadu na to, čo môžu poprední výrobcovia povedať). Čo však s takzvanými akumulátorovými batériami - nabíjateľnými batériami, ktoré môžu počas reakcie energiu nielen spotrebovať, ale aj akumulovať a dlhodobo skladovať?
Aby sme pochopili princíp batérie, je potrebné obrátiť sa na chémiu. Zoberme si to ako príklad... Obyčajný oheň na drevenom uhlí. Bez ohľadu na to, ako plameň môže vyzerať krásne a uhrančivo, každý chemik, ktorý ho pozoruje, vie, že tento proces je len dlhodobou oxidačnou reakciou paliva. Spaľujúce uhlie interaguje s kyslíkom a v dôsledku tejto reakcie dostaneme:
- oxid uhličitý;
- svetlo;
- vrelo.
A ak sú posledné dva body schopné zahriať dušu a telo, potom nemôžeme oxid uhličitý nijako použiť, pretože je to vedľajší produkt reakcie, ktorý je v skutočnosti jeho plytvaním. Oxidačná reakcia sa zastaví, keď sú pôvodné prvky vyčerpané: kyslík a uhlie. K zastaveniu reakcie v batérii dochádza rovnakým spôsobom, keď sa východiskové látky úplne vyčerpajú a zostane iba „odpad“.
V batérii sa všetko deje trochu inak. Faktom je, že reakcia, ktorá v nej prebieha, patrí do kategórie reverzibilných, to znamená, že za určitých podmienok ju možno „zvrátiť“ vrátením všetkých látok do pôvodného stavu. Je to možnosť reverzibilnej reakcie v batérii, ktorá umožňuje jej nabíjanie.
V batérii pripojenej k sieti prebieha reakcia opačným smerom a prúd prúdi z „plus“ do „mínus“ a nie naopak. Výsledkom je, že reakčný produkt tvorí počiatočné látky a vlastník batérie dostáva dostupnú „regenerovanú“ energiu v prenosnom formáte. To je všetko!
Prihláste sa na odber našich sociálnych sietí


