Hur fungerar en väggklocka, TV -fjärrkontroll eller radiostyrd barns leksak? De flesta människor kommer utan tvekan att svara - "från batterier" och kommer i princip att ha rätt. Men knappt någon av dem kommer att kunna berätta hur exakt ett bärbart batteri tredubblas, hur det funktioner och utan vilken hela processen att överföra elektrisk ström från batteriet till slutkonsumenten skulle vara omöjlig. Låt oss fylla denna irriterande kunskapslucka.
Hur batteriet fungerar
Innehållet i artikeln
- Hur batteriet fungerar
- Hur fungerar ett laddningsbart batteri, dess skillnad från ett vanligt
För att förstå funktionsprincipen för ett konventionellt "finger" -batteri är det nödvändigt att ha en allmän uppfattning om dess struktur. Så, vilket batteri som helst består av tre huvudelement - anod, katod och elektrolyt. Dessutom kan den senare ha praktiskt taget vilket aggregationstillstånd som helst: placeras i en saltlösning katoden och anoden är i princip också ett "batteri", bara på ett ovanligt sätt för den vanliga mannen på gatan form.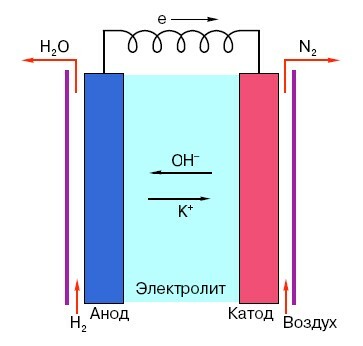
Intressant! Den så kallade "voltaiska pelaren", uppfunnet av Alessandro Volta, hade också alla element som är nödvändiga för produktion av elektrisk ström. Den bestod av zink- och kopparplattor staplade ovanpå varandra, mellan vilka en duk i syra var placerad som ett "lager".
Anoden i sådana system är huvudkällan till elektroner, som, som vi vet från skolans fysikkurs, har en negativ laddning. Negativt laddade partiklar lockas till positiva, och i detta fall fungerar katodytan som ett "plus".
Men för uppkomsten av en elektrisk ström är detta inte tillräckligt, eftersom elektroner också behöver ett slags "motorväg" - ett medium som skulle stödja interaktionen mellan katoden och anoden. Det är här som elektrolyten visas "på scenen" - salt, alkali eller syra som kan leda ström.
Låt oss analysera driftsprincipen med ett specifikt exempel: det finns ett batteri avsett för 18 volt. Spänningen mellan elektroderna i den är stabil tills den är ansluten till nätverket. Så snart en konsument dyker upp (till exempel en vanlig glödlampa) börjar spänningen gradvis minska, från den "negativa" elektroden till "Positiv" ström kommer att börja flöda, och en kemisk reaktion kommer att äga rum i elektrolyten, för att upprätthålla potentialskillnaden mellan elektroder.
Referens. Ju mer energi konsumenten behöver, desto mer intensiv strömmar reaktionen inuti batteriet och desto snabbare kommer den att misslyckas.
Hur fungerar ett laddningsbart batteri, dess skillnad från ett vanligt
Så vi har undersökt de klassiska "finger" och "lillfingret" batterierna och vi vet att livslängden för de flesta av dem är strikt begränsad (vad de framstående tillverkarna än säger). Men hur är det med de så kallade ackumulatorbatterierna - laddningsbara batterier som inte bara kan förbruka energi under reaktionen, utan också kan ackumulera den och lagra den länge?
För att förstå principen för batteriet är det nödvändigt att vända sig till kemi. Låt oss ta som ett exempel... En vanlig koleld. Oavsett hur vacker och förtrollande lågan kan se ut, vet alla kemister som observerar den att denna process bara är en långsiktig oxidationsreaktion av bränslet. Brinnande kol interagerar med syre och som ett resultat av denna reaktion får vi:
- koldioxid;
- ljus;
- varmt.
Och om de två sista punkterna kan värma själ och kropp, så kan vi inte använda koldioxid på något sätt, eftersom det är en biprodukt av reaktionen, som faktiskt är dess slöseri. Oxidationsreaktionen stannar när de första elementen är slut: syre och kol. Reaktionen stoppas i batteriet på samma sätt när utgångssubstanserna helt tömmer sig och bara "avfall" återstår.
I batteriet händer allt lite annorlunda. Faktum är att reaktionen som äger rum i den tillhör kategorin reversibel, det vill säga under vissa förhållanden kan den "vändas" genom att alla ämnen återgår till sitt ursprungliga tillstånd. Det är möjligheten till en reversibel reaktion i batteriet som gör det möjligt att ladda det.
I ett batteri anslutet till nätverket fortsätter reaktionen i motsatt riktning, och strömmen flyter från "plus" till "minus", och inte tvärtom. Som ett resultat bildar reaktionsprodukten de ursprungliga substanserna, och ägaren av batteriet tar emot tillgänglig "återvunnen" energi i ett portabelt format. Det är allt!
Prenumerera på våra sociala nätverk